Autor: Luis Adrian Soto Mota
Introducción
Los cuerpos cetónicos son compuestos solubles en agua derivados de la grasa que produce el hígado humano como parte de las adaptaciones fisiológicas a la escasez de carbohidratos (1). Durante el ayuno, un adulto produce entre 150 y 175 gr de cuerpos cetónicos todos los días [2-3].
Metabolismo de los cuerpos cetónicos
Producción de cuerpos cetónicos
La combinación de insulina baja con alto cortisol y glucagón estimula a los adipocitos para liberar ácidos grasos no esterificados en el torrente sanguíneo. Los ácidos grasos son tomados por hepatocitos, que es donde tiene lugar la cetogénesis. Las Acetil-coenzima acetiltransferasas (ACAT) son enzimas presentes en todas las células que catalizan la formación de acetoacetil-coA (AcAc-CoA) a partir de dos moléculas de acetil-CoA, y viceversa (Figura 1). El AcAc-CoA se convierte en 3-hidroximetilglutaryl-CoA (HMG-CoA) por la HMG-CoA sintasa. La HMG-CoA lyase separa el HMG-CoA, liberando acetil-CoA y acetoacetato (AcAc) (3). A partir de este punto, AcAc puede tener uno de tres destinos: entrar en el torrente sanguíneo a través de los transportadores de monocarboxilatos (MCT) 1–4, espontáneamente descarboxilarse en CO2 y acetona (ambas son moléculas solubles en grasa que se difunden fuera de los hepatocitos y salen del cuerpo a través de los pulmones), o ser reducido a beta hidroxibutirato y salir a través del MCT (4).
Oxidación de cuerpos cetónicos
En los tejidos diana, el HB se oxida en AcAc en la reacción inversa catalizada por la beta hidroxibutirato deshidrogenasa. A continuación, la sucintil-coA-3-oxaloácido CoA transferasa (SCOT) convierte AcAc y succinyl-CoA en AcAc-CoA y succinato. El AcAc-CoA es entonces cortado por acetil coenzima A acetiltransferasa (ACAT) para producir dos moléculas de acetil-CoA que pueden entrar en el ciclo Krebs.
Para evitar usar lo se que acaba de producir, los hepatocitos no expresan SCOT, y por lo tanto son incapaces de metabolizar los cuerpos cetónicos que producen (5). Vale la pena enfatizar que, en contraste con la conversión de glucosa en piruvato a través de la glucólisis, el metabolismo de los cuerpos cetónicos no requiere el uso de ATP. Las reacciones implicadas en la producción y oxidación de cuerpos cetónicos se ilustran en la Figura 1.
Es importante destacar que la cetólisis es un proceso cataplerótico. Para ser oxidada, cada molécula de acetil-CoA derivada de cetona-cuerpo requiere ser emparejada con una molécula de oxaloacetato derivada de carbohidratos/aminoácidos a través de anaplerosis (porque la mayoría de los animales no pueden convertir ácidos grasos en oxaloacetato debido a la falta de malato sintasa y liasa de isocitrato) [5].
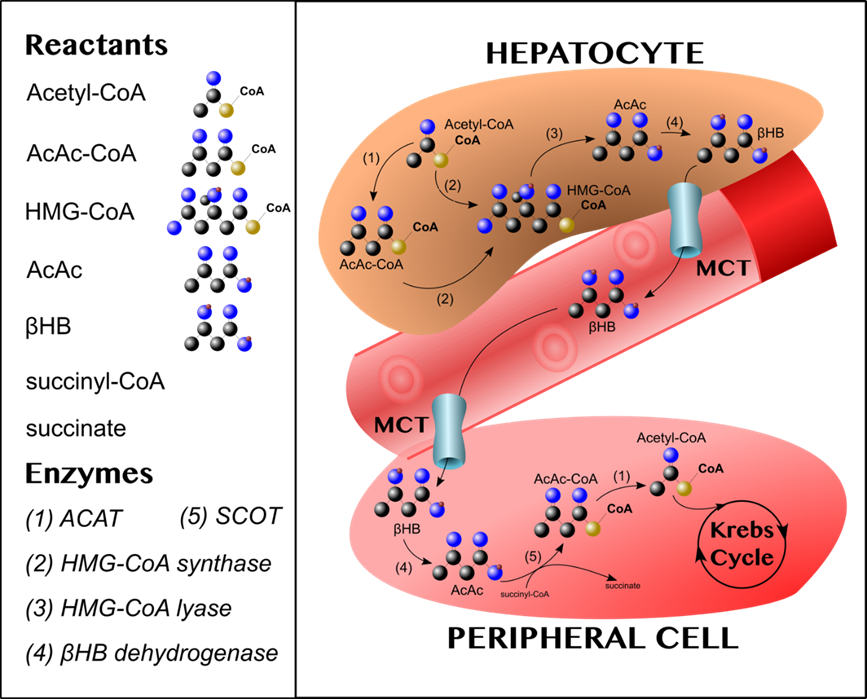
Figura 1.1 – Producción y oxidación de cuerpos de cetona.
AcAc-CoA se combina con otra acetil-CoA por la HMG-CoA sintasa (2) para formar 3-hidroximetilglutaryl-CoA (HMG-CoA). La HMG-CoA liasa (3) corta HMG-CoA, liberando acetil-CoA y el cuerpo cetónico, acetoacetato (AcAc). A continuación, el AcAc puede reducirse a Beta hidroxibutirato mediante la deshidrogenasa de Beta hydroxy butirato (βHB) (4). El βHB, es el cuerpo cetónico más abudante en la sangre y sale de los hepatocitos a través de transportadores de monocarboxilato (MCT) y viaja a través de la circulación a los tejidos periféricos. Una vez allí, el βHB se oxida de nuevo en AcAc por la deshidrogenasa de βHB (4). En el paso crucial de la cetólisis, succinil-CoA-3-oxaloacid CoA transferasa (SCOT) (5) convierte AcAc y succinyl-CoA en AcAc-CoA y succinato. El AcAc-CoA es entonces cortado por ACAT (1) para producir dos moléculas de acetil-CoA que pueden entrar en el ciclo Krebs (Figura diseñada por Nicholas Norwitz, de [7]).(6)(6)(6)(6)(6)(6)(6)(6)
Hay muchas maneras de medir y comparar la eficiencia metabólica de los diferentes sustratos. En la más fisiológicamente relevante de ellas, la eficiencia metabólica se define como la producción de ATP por mol de oxígeno consumido. Dado que la producción de ATP depende directamente del gradiente de protones a través de la membrana interna mitocondrial, la producción de ATP está directamente relacionada con el intervalo redox entre los componentes de la cadena de transporte de electrones y esta inversamente vinculada a la expresión de proteínas de desacoplamiento en la membrana mitocondrial interna.
Bioenergética de la oxidación de cuerpos cetónicos
Debido a que la oxidación de ácidos grasos promueve la expresión de proteínas de desacoplamiento (a través de la regulación de la transcripción de PPAR) y los cuerpos cetónicos están más reducidos que el piruvato (debido a una mayor relación entre hidrógeno y carbono), los cuerpos cetónicos son un sustrato metabólico más eficiente en comparación con otros sustratos metabólicos.
Además, durante la β-oxidación, la mitad de los equivalentes reductores entran en la cadena de transporte de electrones lo hace a través del Complejo II, que tiene una diferencia de potencial de reducción más pequeña que el de la pareja-Q con el Complejo I (-0,22 vs 0,32 E’0). Como resultado, la producción de ATP es más eficiente al oxidar cuerpos cetónicos que cuando se oxidan ácidos grasos.
Por último, vale la pena mencionar que la mayoría de las especies reactivas de oxígeno se producen entre en el ciclo Q. Por lo tanto, debido a que la cetolisis preserva a la pareja-Q oxidada (a diferencia de la oxidación β), es razonable suponer que se producen menos especies reactivas de oxígeno durante la cetólisis que durante la oxidación β.
Excreción de cuerpos cetónicos
Casi inmediatamente después de su producción, la acetona se excreta a través de los pulmones (4). Por otro lado, aunque con diferentes cinéticas, tanto el AcAc como el βHB se excretan por los riñones (7). Es importante señalar que su reabsorción es casi completa durante la inanición (8).
Regulación del metabolismo de los cuerpos cetónicos
Como ya se mencionó anteriormente, los estímulos para la cetogénesis provienen de la demanda de combustible oxidativo cuando las reservas de carbohidratos son bajas. Esto es “comunicado” a los adipocitos como una concentración baja de insulina, cortisol alto y altas concentraciones en la sangre de glucagón (4). Importantemente, el βHB también regula su propia producción mediante la inhibición de la lipólisis a través de receptores nicotínicos PUMA-G en los adipocitos con lo que se disminuye la disponibilidad de ácidos grasos libres para producir cuerpos cetónicos (9).
Dentro de los hepatocitos, las tasa de producción de cuerpos cetónicos está regulada, no sólo por el flujo de ácidos grasos y las concentraciones de acetil-CoA sino también por la regulación de la 3-hidroxi-3-metilglutaril CoA sintasa 2 a través de SIRT3 (10). Vale la pena señalar que la conversión de AcAc en βHB y viceversa, se produce en una reacción de equilibrio acoplada a NAD+/ NADH y que la relación de AcAc/HB es proporcional a la relación NAD+/NADH mitocondrial.
En otras palabras, la actividad de la deshidrogenasa de βHB modula el potencial redox mitocondrial y asegura que los cuerpos cetónicos se oxiden en proporción a la demanda celular de ATP (11). Además, debido a que los MCT sontransportadores acoplados H+,la relación NAD+/NADH en los tejidos diana influye en la absorción celular y la oxidación proporcionalmente a sus necesidades energéticas (12).
Papel de los cuerpos cetónicos en la fisiología humana
Las funciones que desempeñan los cuerpos cetónicos en la fisiología humana son muchas y se pueden dividir conceptualmente en dos: como fuente de carbono y como moléculas de señalización (13).
Los cuerpos cetónicos como fuente de carbono para el metabolismo
El cerebro humano consume 100 – 120 g de glucosa todos los días. En la inanición, se descomponen 1,75 g de proteína muscular para producir 1 g de glucosa, lo que resulta en músculo proteico que se gasta rápidamente. Para evitar este problema, se genera un combustible soluble en agua derivado de la grasa, capaz de sustituir a la glucosa como combustible principal en el cerebro y capaz de cruzar la barrera cerebro-sangre: cuerpos cetónicos (14).
Funciones de señalización de los cuerpos cetónicos
Los cuerpos cetónicos son mucho más que un combustible para sostener el metabolismo; tienen propiedades de señalización similares a muchas hormonas para regular el gasto energético [16] . Además, pueden cambiar directamente la expresión génica para coordinar la adaptación a la escasez prolongada de nutrientes mediante la des acetilación de histonas [17] e incluso mediante la unión directa a las mismas (17).
Efectos específicos de la cetosis en diferentes tejidos y sus posibles aplicaciones clínicas.
Efectos en el cerebro
Es importante señalar que el cerebro es metabólicamente inflexible ya que sólo puede oxidar glucosa y cuerpos cetónicos. Aunque las neuronas, astrocitos y oligodendrocitos metabolizan cuerpos cetónicos estos son utilizados selectivamente por regiones cerebrales individuales (18). Se estima que, durante la inanición, los cuerpos cetónicos alimentan hasta el 60% de las necesidades metabólicas del cerebro (19).
Dado que la privación energética es un fenómeno fisiopatológico que contribuye en muchas enfermedades neurológicas [21–23], añadir una fuente independiente a la glucosa podría ser beneficioso. Sin embargo, una vez más, el papel de los cuerpos cetónicos va más allá del de simplemente ser un combustible para el metabolismo. El βHB directamente influye en la actividad de los canales K y Ca, reduce el estrés oxidativo y puede corregir el disparo neuronal aberrante (23,24).
La cetosis se ha utilizado como tratamiento para la epilepsia durante muchas décadas [26] y actualmente se está investigando como un tratamiento potencial para numerosas enfermedades neurológicas como la migraña [27], Parkinson [28] y la Enfermedad de Alzheimer (27). También, digno de mención, la evidencia emergente sugiere que la cetosis podría ayudar a tratar muchas enfermedades psiquiátricas diferentes [30] particularmente la esquizofrenia [31,32] y el trastorno de ansiedad generalizada (31–33).
Efectos en el corazón
El tejido cardíaco es un ávido consumidor de cuerpos cetónicos (34). Curiosamente, la disfunción bioenergética es una característica distintiva de la insuficiencia cardíaca [37] y el corazón enfermo cambia su metabolismo a uno más cetolítico (36). Incluso, se ha demostrado que los cuerpos cetónicos mejoran la función cardíaca en animales [39] y humanos (38).
Efectos sobre el músculo esquelético
Podría decirse, que el metabolismo de los cuerpos cetónicos evolucionó para preservar la masa muscular. Se ha demostrado que los cuerpos cetónicos reducen la oxidación de los aminoácidos de cadena ramificada [41] y la síntesis de glucógeno [42] en humanos. Las intervenciones cetogénicas son un tratamiento potencial muy atractivo para enfermedades caracterizadas por la sarcopenia. En contraste con las tasas de oxidación lineales de cuerpos cetónicos en el cerebro, las tasas de oxidación de en el músculo esquelético muestran una cinética de saturación (41).
Efectos en el intestino
Se ha demostrado que los cuerpos cetónicos tienen un papel en el mantenimiento de la homeostasis de células madre intestinales [44] y hay evidencia anecdótica de su éxito en el tratamiento de la enfermedad inflamatoria intestinal (43).
Efectos en el sistema inmunológico.
Estudios recientes muestran que los cuerpos cetónicos mejoran la inflamación al regular directamente el inflamasoma (44) y la población de células inmunes (45,46). Notablemente, estos efectos antiinflamatorios no afectan la respuesta contra los antígenos bacterianos (47).
Diferencias entre cetoacidosis y cetosis endógena o exógena
La cetosis nutricional es el estado metabólico en el que los cuerpos cetónicos se convierten en una fuente relevante de energía para los tejidos periféricos, y debe diferenciarse de la cetoacidosis ya que se produce sin alteraciones en balance ácido base (48).
Consumiendo una dieta occidental típica, el nivel de sangre de βHB está usualmente por debajo de 0,2 mmol/L. Después de 16 horas de ayuno o siguiendo una dieta muy baja en carbohidratos y con alto contenido de grasa, su concentración comienza a aumentar gradualmente y se estabiliza alrededor de 5.0 mmol/L después de 20 días (2).
El aumento de las cetonas de la sangre no es el único cambio fisiológico durante la inanición o la restricción de carbohidratos y las sales cetonas y los ésteres tienen perfiles farmacodinámicos y farmacocinéticos muy diferentes (49). Por lo tanto, sería erróneo suponer que todas las intervenciones que elevan el βHB son equivalentes o que su tolerabilidad es comparable (50).
Es importante diferenciar la cetosis nutricional de la cetoacidosis. A pesar de ser ácidos, los propios cuerpos cetónicos no son la causa de la acidosis metabólica que acompaña a la cetoacidosis [52] y la lesión renal parece ser esencial para su desarrollo (52). La acidosis metabólica característica de la cetoacidosis es consecuencia típicamente de la falla renal ocasionada por la deshidratación secundaria a la oliguria o sepsis. Vale la pena recalcar que los pacientes con cetoacidosis pueden llegar a tener niveles de hasta 25.0 mM de βHB en la sangre y que esto sólo es posible en el contexto de una falta de excreción renal (consecuencia de una lesión renal aguda).
Cetosis nutricional endógena
En pacientes cuidadosamente seleccionados y con un seguimiento cercano, el ayuno hasta por más de un año ha demostrado ser seguro, y durante siglos, millones de personas han ayunado con seguridad como parte de sus prácticas religiosas (53). Hay muchos tipos diferentes de ayuno (total, parcial o intermitente) sin embargo, a nivel molecular, todos ellos tienen consecuencias metabólicas similares (54).
Por supuesto, no todas las formas de ayuno intermitente aumentan significativamente las concentraciones de cuerpos cetónicos en la sangre (por ejemplo, ayunar durante 16 horas o menos cada día) ya que se necesitan al menos 72 horas para que la producción hepática de βHB sea importante (55).
El perfil hormonal del ayuno es quizás la mayor diferencia entre las diferentes formas de cetosis nutricional. Un ambiente bajo de insulina + alto cortisol y glucagón promoverá en gran medida la lipólisis que, en este escenario, será regulada principalmente por la retroalimentación negativa de βHB.
El efecto del cortisol sobre los adipocitos también está regulado por insulina; cuando la insulina es baja, el cortisol promueve la lipólisis y cuando la insulina es alta, promueve el almacenamiento de grasa y la lipogénesis (56).
Por otro lado, las dietas cetogénicas también causan baja insulina + alto cortisol y glucagón, sin embargo, difieren del ayuno en que los cuerpos cetónicos también se pueden producir a partir de la grasa ingerida y no sólo a partir de la grasa previamente almacenada. Como resultado, el βHB aumenta más rápidamente y la lipólisis se detiene más rápido que con el ayuno.
También, vale la pena mencionar que no todas las fuentes de grasa son igualmente eficientes para elevar a los cuerpos cetónicos en la sangre. Los alimentos ricos en ácido octanoico son particularmente cetogénicos en comparación con otras fuentes (57). En contraste con el ayuno, las dietas cetogénicas tienden a alcanzar niveles sanguíneos más bajos que otras intervenciones cetogénicas (2,0 vs 5,0) y, dado que existen muchas variables, es muy difícil alcanzar un objetivo específico de nivel sanguíneo (58).
Cetosis nutricional exógena
Las sales de cetonas han existido, y se han utilizado en la investigación biomédica durante décadas (59). Sin embargo, nunca se ha considerado que tienen aplicaciones clínicas potenciales porque el hígado produce al menos 75 gr de HB por día [2] y las sales producen 50% de la forma biológicamente inactiva “L” [3] por lo tanto, se necesitaría consumir 300 gr para imitar la producción cetogénica durante la respuesta en ayunas.
Por otro lado, los ésteres cetónicos permiten alcanzar niveles de βHB similares a los del ayuno en 30 minutos de forma segura y precisa. Por otra parte, sólo producen la forma D de βHB y están libres de sal (60).
Es importante señalar que incluso cuando tanto las sales de cetona y los ésteres cetónicos elevan el βHB y bajan la glucosa en sangre y los ácidos grasos libres, tienen diferentes efectos metabólicos y de seguridad. Las sales producen alcalosis aguda, mientras que los ésteres inducen acidosis transitoria y también producen diferentes cambios transitorios en las concentraciones de electrolitos en sangre (49).
Un “punto medio” notable entre las intervenciones cetogénicas endógenas y exógenas es el consumo de ácidos grasos de cadena media (MCTS). Después de su ingestión, se absorben rápidamente en el sistema portal y se convierten en cuerpos cetónicos en los hepatocitos. En otras palabras, son un precursor cetogénico exógeno convertido en cetonas por medios endógenos normales. Si bien, aumentan agudamente la concentración de sangre de βHB, lo hacen moderadamente y no permiten la valoración precisa de la concentración de βHB (61).
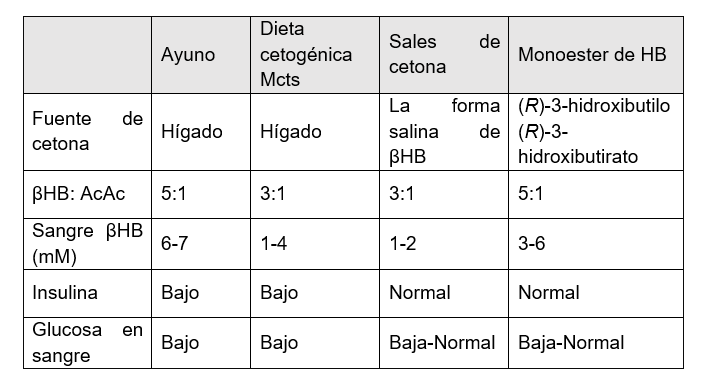
Una cosa que los aceites de ácidos grasos de cadena mediana y las cetonas exógenas tienen en común es que su consumo puede inducir molestias gastrointestinales. Sin embargo, la frecuencia y la gravedad de estos síntomas son específicos de dosis y compuestos (50). La Tabla 1.1 resume las diferencias entre las intervenciones cetogénicas disponibles.
Tabla 1.1 – Resumen de las diferencias metabólicas entre cetosis endógena y exógena.
La cetosis y la diabetes
– El efecto hipoglucémico de los cuerpos cetónicos y otros beneficios potenciales para el tratamiento de la diabetes mellitus.La cetosis y la diabetes
Se ha sabido durante décadas que inducir la cetosis disminuye la glucosa en sangre en cuestión de minutos. Esto se ha observado en muchos animales diferentes y con todas las intervenciones que elevan βHB en cuestión de minutos (sales de cetona, ésteres de cetonas y aceites MCT) (62–65).
Importantemente, este efecto hipoglucémico es mayor en las personas que viven con diabetes [60] y no se limita a bajar la glucosa en ayunas ya que una sola dosis del monoester cetona reduce la glucosa postprandial después de un desafío de dextrosa en humanos sanos (66).
Sin embargo, controlar la glucosa en sangre es sólo uno de los muchos objetivos terapéuticos al tratar la diabetes mellitus. Los marcadores lipídicos, la presión arterial y la actividad física se consideran objetivos igualmente importantes en el cuidado de la diabetes [71] . En un modelo animal, estos mejoraron durante la cetosis (68).
Los cambios en el estilo de vida son la piedra angular del tratamiento de la diabetes y la evidencia sugiere que la cetosis podría facilitar los cambios de comportamiento requeridos suprimiendo el apetito [73,74] y promoviendo la actividad física (68).
Por último, la mayoría de las personas que viven con diabetes perecen debido a complicaciones cardiovasculares (71), los efectos ya mencionados específicos del cardiaco de los cuerpos cetónicos podrían ser además útiles y relevantes para los pacientes con diabetes (72).
La cetosis mejora tanto la secreción de insulina como la sensibilidad periférica a la insulina
También se ha sabido durante décadas que el βHB mejora la secreción de insulina (73,74). Además, se ha demostrado que las infusiones de cetona influyen positivamente en la sensibilidad periférica a la insulina en animales y seres humanos (75,76). Curiosamente, los estudios muestran que el efecto hipoglucémico de la cetosis puede ser independiente de la insulina (59,66,77). Estos resultados contrastantes se explican parcialmente por la observación de un umbral específico y particularmente alto de la concentración de βHB para estimular la secreción de insulina (78).
Seguir una dieta cetogénica revierte la diabetes tipo 2
Durante la última década, muchos estudios diferentes han demostrado beneficios conductuales (79) y en el estilo de vida (80) a cort [85] y a largo plazo [86] para pacientes con diabetes cuando siguen una dieta cetogénica.
El estudio de seguimiento más largo hasta la fecha sobre dieta cetogénica en pacientes con diabetes reportó que más de la mitad de los pacientes (53%) que continuaron el estudio estaban libres de enfermedades (definidas como tener HbA1c normal) después de dos años (83).
Todavía se debate si estos resultados exitosos se explican mejor por una mejora en la salud de las células beta (84), por efectos que imitan a los observados con una cirugía de Y-Roux (85,86), por consumo de las reservas de glucógeno hepático y la restricción de calorías (87), la reducción de la grasa hepática y del páncreas (88,89), o como consecuencia directa del efecto hipoglucémico de los cuerpos cetónicos. Probablemente, estos mecanismos se traslapan o superponen.
Mitos y Controversias respecto a la dieta cetogénica
1. La dieta cetogénica es peligrosa para pacientes con diabetes porque:
a) Aumenta el riesgo de cetoacidosis.
Esto es falso. Como ya se explicó, ni la dieta cetogénica ni los cuerpos cetónicos por sí mismos son suficientes para inducir cetoacidosis. Esta última es resultado de la falla renal aguda que ocasiona una menor excreción de cuerpos cetónicos y que suele ser consecuencia de deshidratación por oliguria o sepsis (51,52,90).
b) Causa dislipidemia.
Esto es controvertido. Es cierto que algunos pacientes presentan elevación en la concentración de LDL y de colesterol total como consecuencia de seguir una dieta cetogénica. Sin embargo, se ha reportado que un panel de lípidos típico es probablemente insuficiente para evaluar a un paciente que sigue una dieta cetogénica porque el subtipo de partículas LDL y su número cambia (no sólo la concentración total) (43).
Vale la pena enfatizar que no todos los subtipos de partículas LDL confieren el mismo riesgo cardiovascular (91) y que la dieta cetogénica disminuye importantemente la concentración de triglicéridos en la sangre (43). Lo más recomendable es seguir a estos pacientes por lo menos con mediciones de ApoB y ApoA además del perfil de lípidos habitual.
c) Implica aumentar el consumo de grasas saturadas.
Esto es cierto. Sin embargo, es importante recalcar que la evidencia más reciente no apoya la hipótesis de que las grasas saturadas elevan el riesgo cardiovascular y las recomendaciones más actuales respecto su consumo no sugieren disminuir su consumo (92). De cualquier forma, se debe enfatizar la importancia de elegir fuentes más saludables de grasa (nueces, aguacate, pescado) sobre alimentos procesados con un alto contenido de grasa (por ejemplo, los embutidos)
2. Consumir cetonas exógenas ayuda a perder peso.
Esto es falso. Como ya se mencionó, el βHB inhibe su propia producción por lo que estos suplementos de hecho inhiben la lipolisis y tienen un efecto neutro en el peso (9,90).
3. Se pierde masa muscular con la dieta cetogénica.
Esto es controvertido. Ciertamente se reduce la cantidad de glucógeno intramuscular y por consiguiente, agua intramuscular. Esto lleva a una disminución transitoria de volumen muscular que es detectable con varios métodos de evaluación de la composición corporal (93).
Sin embargo, la reserva de glucógeno se repone gradualmente ya que el βHB aumenta su síntesis y precisamente tiene como objetivo preservar la reserva de proteína muscular (39,40). Esta, sólo puede ser evaluada por medio de biopsias y no ha habido suficientes estudios que incluyan estas mediciones para concluir fehacientemente el resultado a largo plazo. En todo caso, es posible concluir que incluso si hay pérdida de proteína muscular, esta es pequeña, probablemente autolimitada y no confiere riesgos importantes.
REFERENCIAS
- Cahill GF, Herrera MG, Morgan AP, Soeldner JS, Steinke J, Levy PL, et al. Hormone-fuel interrelationships during fasting. J Clin Invest [Internet]. 1966 Nov 1 [cited 2019 Dec 7];45(11):1751–69. Available from: http://www.jci.org/articles/view/105481
- Reichard GA, Owen OE, Haff AC, Paul P, Bortz WM. Ketone-body production and oxidation in fasting obese humans. J Clin Invest [Internet]. 1974 Feb 1 [cited 2020 Jul 29];53(2):508–15. Available from: http://www.jci.org/articles/view/107584
- Puchalska P, Crawford PA. Multi-dimensional Roles of Ketone Bodies in Fuel Metabolism, Signaling, and Therapeutics. Cell Metab [Internet]. 2017 Feb [cited 2020 Jul 29];25(2):262–84. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1550413116306556
- Cahill GF, George FC. Fuel Metabolism in Starvation. Annu Rev Nutr [Internet]. 2006 Aug [cited 2020 Mar 2];26(1):1–22. Available from: www.annualreviews.org
- Orii KE, Fukao T, Song X-QQ, Mitchell GA, Kondo N. Liver-Specific Silencing of the Human Gene Encoding Succinyl-CoA: 3-Ketoacid CoA Transferase. Tohoku J Exp Med [Internet]. 2008 [cited 2019 Dec 7];215(3):227–36. Available from: https://pubmed.ncbi.nlm.nih.gov/18648183/
- Soto-Mota A, Norwitz NG, Clarke K. Why a D-β-hydroxybutyrate monoester? Biochem Soc Trans [Internet]. 2020 Feb 28 [cited 2020 Feb 26];48(1):51–9. Available from: https://portlandpress.com/biochemsoctrans/article/doi/10.1042/BST20190240/222188/Why-a-dβhydroxybutyrate-monoester
- Galvin RD, Harris JA, Johnson RE. URINARY EXCRETION OF BETA-HYDROXYBUTYRATE AND ACETOACETATE DURING EXPERIMENTAL KETOSIS. Q J Exp Physiol Cogn Med Sci [Internet]. 1968 Apr 7 [cited 2020 Jul 29];53(2):181–93. Available from: http://doi.wiley.com/10.1113/expphysiol.1968.sp001958
- Wildenhoff KE. THE RENAL EXCRETION OF ACETOACETATE AND 3-HYDROXYBUTYRATE DURING ABSOLUTE FASTING. Acta Med Scand [Internet]. 2009 Apr 24 [cited 2020 Jul 29];192(1–6):475–9. Available from: http://doi.wiley.com/10.1111/j.0954-6820.1972.tb04849.x
- Taggart AKP, Kero J, Gan X, Cai TQ, Cheng K, Ippolito M, et al. (D)-β-hydroxybutyrate inhibits adipocyte lipolysis via the nicotinic acid receptor PUMA-G. J Biol Chem [Internet]. 2005 Jul 22 [cited 2019 Oct 4];280(29):26649–52. Available from: http://www.jbc.org/lookup/doi/10.1074/jbc.C500213200
- Grabacka M, Pierzchalska M, Dean M, Reiss K. Regulation of Ketone Body Metabolism and the Role of PPARα. Int J Mol Sci [Internet]. 2016 Dec 13 [cited 2018 Apr 18];17(12):2093. Available from: http://www.mdpi.com/1422-0067/17/12/2093
- Rojas-Morales P, Tapia E, Pedraza-Chaverri J. β-Hydroxybutyrate: A signaling metabolite in starvation response? Cell Signal [Internet]. 2016 Aug [cited 2018 Apr 12];28(8):917–23. Available from: https://ac.els-cdn.com/S0898656816300900/1-s2.0-S0898656816300900-main.pdf?_tid=d4892ea8-144d-4ff4-9f82-ced6235150bf&acdnat=1523528708_dddd5a5c7e4614b8e6365f6dd8308174
- Halestrap AP. The SLC16 gene family-Structure, role and regulation in health and disease [Internet]. Vol. 34, Molecular Aspects of Medicine. 2013 [cited 2019 Apr 13]. p. 337–49. Available from: http://dx.doi.org/10.1016/j.mam.2012.05.003
- Newman JC, Verdin E. β-hydroxybutyrate: Much more than a metabolite [Internet]. Vol. 106, Diabetes Research and Clinical Practice. 2014 [cited 2018 Apr 12]. p. 173–81. Available from: http://www.diabetesresearchclinicalpractice.com/article/S0168-8227(14)00334-9/pdf
- Felig P, Owen OE, Wahren J, Cahill GF. Amino acid metabolism during prolonged starvation. J Clin Invest [Internet]. 1969 Mar 1 [cited 2020 May 2];48(3):584–94. Available from: http://www.jci.org/articles/view/106017
- Kimura I, Inoue D, Maeda T, Hara T, Ichimura A, Miyauchi S, et al. Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41 (GPR41). Proc Natl Acad Sci U S A. 2011 May 10;108(19):8030–5.
- Shimazu T, Hirschey MD, Newman J, He W, Shirakawa K, Le Moan N, et al. Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science (80- ). 2013 Jan 11;339(6116):211–4.
- Xie Z, Zhang D, Chung D, Tang Z, Huang H, Dai L, et al. Metabolic Regulation of Gene Expression by Histone Lysine β-Hydroxybutyrylation. Mol Cell [Internet]. 2016 Apr 21 [cited 2020 Mar 2];62(2):194–206. Available from: http://dx.doi.org/10.1016/j.molcel.2016.03.036
- Hawkins RA, Biebuyck JF. Ketone bodies are selectively used by individual brain regions. Science (80- ) [Internet]. 1979 Jul 20 [cited 2020 Jul 29];205(4403):325–7. Available from: https://science.sciencemag.org/content/205/4403/325
- Cahill GF, Owen OE. Starvation and survival. Trans Am Clin Climatol Assoc [Internet]. 1968 [cited 2020 Jul 29];79:13–20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/5667163
- Gross EC, Lisicki M, Fischer D, Sándor PS, Schoenen J. The metabolic face of migraine — from pathophysiology to treatment. Nat Rev Neurol [Internet]. 2019 Nov 4 [cited 2019 Oct 5];15(11):627–43. Available from: http://www.nature.com/articles/s41582-019-0255-4
- Norwitz NG, Soto-Mota, Adrian. Norwitz SG, Clarke K. Multi-Loop Model of Alzheimer Disease: An Integrated Perspective on the Wnt/GSK3β, α-Synuclein, and Type 3 Diabetes Hypotheses. Front Aging Neurosci [Internet]. 2019 Jul 31 [cited 2019 Sep 26];11. Available from: https://www.frontiersin.org/article/10.3389/fnagi.2019.00184/full
- Hu MTM, Taylor-Robinson SD, Chaudhuri KR, Bell JD, Labbé C, Cunningham VJ, et al. Cortical dysfunction in non-demented Parkinson’s disease patients. A combined 31P-MRS and 18FDG-PET study. Brain. 2000;123(2):340–52.
- Jin N, Ziyatdinova S, Gureviciene I, Tanila H. Response of spike-wave discharges in aged APP/PS1 Alzheimer model mice to antiepileptic, metabolic and cholinergic drugs. Sci Rep [Internet]. 2020 Dec 1 [cited 2020 Jul 29];10(1):11851. Available from: https://www.nature.com/articles/s41598-020-68845-y
- D’Agostino DP, Pilla R, Held HE, Landon CS, Puchowicz M, Brunengraber H, et al. Therapeutic ketosis with ketone ester delays central nervous system oxygen toxicity seizures in rats. Am J Physiol – Regul Integr Comp Physiol [Internet]. 2013 May 15 [cited 2019 Dec 7];304(10):R829–36. Available from: https://www.physiology.org/doi/10.1152/ajpregu.00506.2012
- D’Andrea Meira I, Romão TT, Do Prado HJP, Krüger LT, Pires MEP, Da Conceição PO. Ketogenic diet and epilepsy: What we know so far. Front Neurosci [Internet]. 2019 Jan 29 [cited 2020 Mar 2];13(JAN). Available from: www.frontiersin.org
- Gross E, Putananickal N, Orsini AL, Schmidt S, Vogt DR, Cichon S, et al. Efficacy and safety of exogenous ketone bodies for preventive treatment of migraine: A study protocol for a single-centred, randomised, placebo-controlled, double-blind crossover trial 11 Medical and Health Sciences 1103 Clinical Sciences. Trials [Internet]. 2019 Jan 17 [cited 2020 Jul 29];20(1):61. Available from: https://trialsjournal.biomedcentral.com/articles/10.1186/s13063-018-3120-7
- Newport MT, VanItallie TB, Kashiwaya Y, King MT, Veech RL. A new way to produce hyperketonemia: Use of ketone ester in a case of Alzheimer’s disease. Alzheimer’s Dement [Internet]. 2015 Jan [cited 2019 Apr 16];11(1):99–103. Available from: https://linkinghub.elsevier.com/retrieve/pii/S1552526014000326
- Kovács Z, D’Agostino DP, Diamond D, Kindy MS, Rogers C, Ari C. Therapeutic potential of exogenous ketone supplement induced ketosis in the treatment of psychiatric disorders: Review of current literature. Front Psychiatry. 2019;10(MAY).
- Palmer CM, Gilbert-Jaramillo J, Westman EC. The ketogenic diet and remission of psychotic symptoms in schizophrenia: Two case studies. Schizophr Res [Internet]. 2019 Jun 1 [cited 2020 Jul 29];208:439–40. Available from: https://pubmed.ncbi.nlm.nih.gov/30962118/
- Sarnyai Z, Kraeuter AK, Palmer CM. Ketogenic diet for schizophrenia: Clinical implication. Curr Opin Psychiatry. 2019;32(5):394–401.
- Ari C, Kovács Z, Juhasz G, Murdun C, Goldhagen CR, Koutnik AM, et al. Exogenous Ketone supplements reduce anxiety-related behavior in Sprague-Dawley and Wistar Albino Glaxo/Rijswijk rats. Front Mol Neurosci [Internet]. 2016 Dec 6 [cited 2020 Jul 2];9(DEC2016):137. Available from: http://journal.frontiersin.org/article/10.3389/fnmol.2016.00137/full
- Kashiwaya Y, Bergman C, Lee JH, Wan R, King MT, Mughal MR, et al. A ketone ester diet exhibits anxiolytic and cognition-sparing properties, and lessens amyloid and tau pathologies in a mouse model of Alzheimer’s disease. Neurobiol Aging [Internet]. 2013;34(6):1530–9. Available from: http://dx.doi.org/10.1016/j.neurobiolaging.2012.11.023
- Brinkworth GD L-MNDTCHNMBJDWG, Wilson CJ, G.D. B, N.D. L-M, C.H. T, M. N, et al. Long-term effects of very low-carbohydrate and high-carbohydrate weight-loss diets on psychological health in obese adults with type 2 diabetes: randomized controlled trial. J Intern Med [Internet]. 2016;280(4):388‐397. Available from: https://www.cochranelibrary.com/central/doi/10.1002/central/CN-01208699/full
- Cuenoud B, Hartweg M, Godin JP, Croteau E, Maltais M, Castellano CA, et al. Metabolism of Exogenous D-Beta-Hydroxybutyrate, an Energy Substrate Avidly Consumed by the Heart and Kidney. Front Nutr [Internet]. 2020 Feb 19 [cited 2020 Jul 29];7(13):13. Available from: https://www.frontiersin.org/article/10.3389/fnut.2020.00013/full
- Neubauer S. The failing heart – An engine out of fuel [Internet]. Vol. 356, New England Journal of Medicine. 2007 [cited 2018 Apr 12]. p. 1140–51. Available from: http://www.nejm.org/doi/pdf/10.1056/NEJMra063052
- Aubert G, Martin OJ, Horton JL, Lai L, Vega RB, Leone TC, et al. The Failing Heart Relies on Ketone Bodies as a Fuel. Circulation [Internet]. 2016 Feb 23 [cited 2018 Apr 12];133(8):698–705. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26819376
- Sato K, Kashiwaya Y, Keon CA, Tsuchiya N, King MT, Radda GK, et al. Insulin, ketone bodies, and mitochondrial energy transduction. FASEB J [Internet]. 1995 May;9(8):651–8. Available from: http://www.fasebj.org/doi/10.1096/fasebj.9.8.7768357
- Gormsen LC, Svart M, Thomsen HH, Søndergaard E, Vendelbo MH, Christensen N, et al. Ketone body infusion with 3-hydroxybutyrate reduces myocardial glucose uptake and increases blood flow in humans: A positron emission tomography study. J Am Heart Assoc. 2017;6(3):1–12.
- Cox PJ, Kirk T, Ashmore T, Willerton K, Evans R, Smith A, et al. Nutritional Ketosis Alters Fuel Preference and Thereby Endurance Performance in Athletes. Cell Metab [Internet]. 2016;24(2):256–68. Available from: http://dx.doi.org/10.1016/j.cmet.2016.07.010
- Holdsworth DA, Cox PJ, Kirk T, Stradling H, Impey SG, Clarke K. A Ketone Ester Drink Increases Postexercise Muscle Glycogen Synthesis in Humans. Med Sci Sports Exerc [Internet]. 2017 [cited 2018 Apr 23];49(9):1789–95. Available from: https://insights.ovid.com/crossref?an=00005768-201709000-00005
- Mikkelsen KH, Seifert T, Secher NH, Grøndal T, Van Hall G. Systemic, cerebral and skeletal muscle ketone body and energy metabolism during acute hyper-D-β-hydroxybutyratemia in post-absorptive healthy males. J Clin Endocrinol Metab [Internet]. 2015 [cited 2019 Apr 13];100(2):636–43. Available from: https://academic.oup.com/jcem/article-abstract/100/2/636/2814044
- Cheng CW, Biton M, Haber AL, Gunduz N, Eng G, Gaynor LT, et al. Ketone Body Signaling Mediates Intestinal Stem Cell Homeostasis and Adaptation to Diet. Cell [Internet]. 2019 Aug 22 [cited 2020 Jul 29];178(5):1115-1131.e15. Available from: http://www.cell.com/article/S0092867419308487/fulltext
- Norwitz NG, Loh V. A Standard Lipid Panel Is Insufficient for the Care of a Patient on a High-Fat, Low-Carbohydrate Ketogenic Diet. Front Med [Internet]. 2020 Apr 15 [cited 2020 Jul 29];7:97. Available from: https://www.frontiersin.org/article/10.3389/fmed.2020.00097/full
- Youm YH, Nguyen KY, Grant RW, Goldberg EL, Bodogai M, Kim D, et al. The ketone metabolite β-hydroxybutyrate blocks NLRP3 inflammasome-mediated inflammatory disease. Nat Med. 2015 Feb 16;21(3):263–9.
- Goldberg EL, Shchukina I, Asher JL, Sidorov S, Artyomov MN, Dixit VD. Ketogenesis activates metabolically protective γδ T cells in visceral adipose tissue. Nat Metab [Internet]. 2020 Jan 1 [cited 2020 Jul 29];2(1):50–61. Available from: https://www.nature.com/articles/s42255-019-0160-6
- Ni FF, Li CR, Liao JX, Wang GB, Lin SF, Xia Y, et al. The effects of ketogenic diet on the Th17/Treg cells imbalance in patients with intractable childhood epilepsy. Seizure. 2016 May 1;38:17–22.
- Neudorf H, Myette-Côté É, Little JP. The impact of acute ingestion of a ketone monoester drink on LPS-stimulated NLRP3 activation in humans with obesity. Nutrients [Internet]. 2020 Mar 23 [cited 2020 Jul 29];12(3):854. Available from: https://www.mdpi.com/2072-6643/12/3/854
- Volek JS, Freidenreich DJ, Saenz C, Kunces LJ, Creighton BC, Bartley JM, et al. Metabolic characteristics of keto-adapted ultra-endurance runners. Metabolism [Internet]. 2016 Mar 1 [cited 2018 Jun 27];65(3):100–10. Available from: https://www.sciencedirect.com/science/article/pii/S0026049515003340
- Stubbs BJ, Cox PJ, Evans RD, Santer P, Miller JJ, Faull OK, et al. On the metabolism of exogenous ketones in humans. Front Physiol [Internet]. 2017 Oct 30 [cited 2019 Apr 13];8(OCT):848. Available from: http://journal.frontiersin.org/article/10.3389/fphys.2017.00848/full
- Stubbs BJ, Cox PJ, Kirk T, Evans RD, Clarke K. Gastrointestinal Effects of Exogenous Ketone Drinks are Infrequent, Mild and Vary According to Ketone Compound and Dose. Int J Sport Nutr Exerc Metab. 2019;(Figure 1):1–23.
- Green A, Bishop RE. Ketoacidosis – Where Do the Protons Come From? [Internet]. Vol. 44, Trends in Biochemical Sciences. 2019 [cited 2019 May 27]. p. 484–9. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0968000419300052
- Adrogue HJ, Eknoyan G, Suki WK. Diabetic ketoacidosis: Role of the kidney in the acid-base homeostasis re-evaluated. Kidney Int. 1984;25(4):591–8.
- De Cabo R, Mattson MP. Effects of intermittent fasting on health, aging, and disease [Internet]. Longo DL, editor. Vol. 381, New England Journal of Medicine. 2019 [cited 2019 Dec 27]. p. 2541–51. Available from: http://www.nejm.org/doi/10.1056/NEJMra1905136
- Longo VD, Mattson MP. Fasting: Molecular mechanisms and clinical applications. Cell Metab [Internet]. 2014;19(2):181–92. Available from: http://dx.doi.org/10.1016/j.cmet.2013.12.008
- Carter S, Clifton PM, Keogh JB. Effect of Intermittent Compared With Continuous Energy Restricted Diet on Glycemic Control in Patients With Type 2 Diabetes. JAMA Netw Open [Internet]. 2018 Jul 20;1(3):e180756. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L629205569
- Rutkowski JM, Stern JH, Scherer PE. The cell biology of fat expansion. J Cell Biol. 2015;208(5):501–12.
- St-Onge M-P, Jones PJH. Physiological Effects of Medium- Chain Triglycerides : Potential of Obesity. Recent Adv Nutr Sci. 2002;132:329–32.
- Berry SE, Valdes AM, Drew DA, Asnicar F, Mazidi M, Wolf J, et al. Human postprandial responses to food and potential for precision nutrition. Nat Med [Internet]. 2020 Jun 1 [cited 2020 Jul 2];26(6):964–73. Available from: https://doi.org/10.1038/s41591-020-0934-0
- Sherwin RS, Hendler RG, Felig P. Effect of diabetes mellitus and insulin on the turnover and metabolic response to ketones in man. Diabetes. 1976;25(9):776–84.
- Clarke K, Tchabanenko K, Pawlosky R, Carter E, Todd King M, Musa-Veloso K, et al. Kinetics, safety and tolerability of (R)-3-hydroxybutyl (R)-3-hydroxybutyrate in healthy adult subjects. Regul Toxicol Pharmacol [Internet]. 2012 Aug;63(3):401–8. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0273230012000803
- Papamandjaris AA, Macdougall DE, Jones PJH. Medium chain fatty acid metabolism and energy expenditure: Obesity treatment implications. Life Sci. 1998;62(14):1203–15.
- Nakatani T, Yasuda K, Ozawa K, Tobe T. Changes in Blood Glucose Levels in Relation to Blood Ketone Body Ratio following Hypertonic Glucose Infusion in 70% Hepatectomized Rabbits. Eur Surg Res [Internet]. 1984 [cited 2020 May 2];16(5):303–11. Available from: https://www.karger.com/Article/FullText/128423
- Muller MJ, Paschen U, Seitz HJ. Effect of ketone bodies on glucose production and utilization in the miniature pig. J Clin Invest. 1984;74(1):249–61.
- Felts PW, Crofford B, Park CR. Effect of Infused Ketone Bodies on Glucose Utilization in the Dog. Vol. 43, Journal of Clinical Investigation. 1964.
- Ari C, Murdun C, Koutnik AP, Goldhagen CR, Rogers C, Park C, et al. Exogenous ketones lower blood glucose level in rested and exercised rodent models. Nutrients [Internet]. 2019 Oct 1 [cited 2019 Oct 5];11(10):2330. Available from: https://www.mdpi.com/2072-6643/11/10/2330
- Myette-Côté É, Caldwell HG, Ainslie PN, Clarke K, Little JP. A ketone monoester drink reduces the glycemic response to an oral glucose challenge in individuals with obesity: a randomized trial. Am J Clin Nutr [Internet]. 2019 Dec 1 [cited 2019 Dec 6];110(6):1491–501. Available from: https://academic.oup.com/ajcn/article-abstract/110/6/1491/5585428
- Riddle MC. Summary of Revisions: Standards of Medical Care in Diabetes-2020 [Internet]. Vol. 43, Diabetes care. 2020 [cited 2020 Jan 22]. p. S4–6. Available from: https://doi.org/10.2337/dc20-SREV
- Murray AJ, Knight NS, Cole MA, Cochlin LE, Carter E, Tchabanenko K, et al. Novel ketone diet enhances physical and cognitive performance. FASEB J [Internet]. 2016 Dec;30(12):4021–32. Available from: http://www.fasebj.org/doi/10.1096/fj.201600773R
- Stubbs BJ, Cox PJ, Evans RD, Cyranka M, Clarke K, de Wet H. A Ketone Ester Drink Lowers Human Ghrelin and Appetite. Obesity [Internet]. 2018 Feb;26(2):269–73. Available from: http://doi.wiley.com/10.1002/oby.22051
- Gibson AA, Seimon R V., Lee CMY, Ayre J, Franklin J, Markovic TP, et al. Do ketogenic diets really suppress appetite? A systematic review and meta-analysis. Obes Rev [Internet]. 2015 Jan [cited 2019 Nov 4];16(1):64–76. Available from: http://doi.wiley.com/10.1111/obr.12230
- Wright AK, Kontopantelis E, Emsley R, Buchan I, Sattar N, Rutter MK, et al. Life expectancy and cause-specific mortality in type 2 diabetes: A population-based cohort study quantifying relationships in ethnic subgroups. Diabetes Care. 2017 Mar 1;40(3):338–45.
- Mizuno Y, Harada E, Nakagawa H, Morikawa Y, Shono M, Kugimiya F, et al. The diabetic heart utilizes ketone bodies as an energy source. Metabolism [Internet]. 2017 Dec [cited 2018 Apr 12];77:65–72. Available from: http://www.metabolismjournal.com/article/S0026-0495(17)30211-1/pdf
- Balasse E, Ooms H, Lambilliotte J. Evidence for a stimulatory effect of ketone bodies on insulin secretion in man. Horm Metab Res [Internet]. 1970 Jan 8;2(06):371–2. Available from: http://www.thieme-connect.de/DOI/DOI?10.1055/s-0028-1096822
- Ikeda T, Yoshida T, Ito Y, Murakami I, Mokuda O, Tominaga M, et al. Effect of β-hydroxybutyrate and acetoacetate on insulin and glucagon secretion from perfused rat pancreas. Arch Biochem Biophys [Internet]. 1987 Aug 15 [cited 2020 Jul 4];257(1):140–3. Available from: https://linkinghub.elsevier.com/retrieve/pii/0003986187905522
- Park S, Kim DS, Daily JW, S. P, D.S. K, J.W. D. Central infusion of ketone bodies modulates body weight and hepatic insulin sensitivity by modifying hypothalamic leptin and insulin signaling pathways in type 2 diabetic rats. Brain Res [Internet]. 2011;1401:95–103. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L51461692
- Beylot M, Khalfallah Y, Riou JP, Cohen R, Normand S, Mornex R. Effects of ketone bodies on basal and insulin-stimulated glucose utilization in man. J Clin Endocrinol Metab. 1986;63(1):9–15.
- BEYLOT M, CHASSARD D, CHAMBRIER C, GUIRAUD M, ODEON M, BEAUFRERE B, et al. Metabolic effects of a D-β-hydroxybutyrate infusion in septic patients. Crit Care Med [Internet]. 1994 Jul;22(7):1091–8. Available from: http://journals.lww.com/00003246-199407000-00007
- Biden TJ, Taylor KW. Effects of ketone bodies on insulin release and islet-cell metabolism in the rat. Biochem J. 1983;212(2):371–7.
- Nishimori E, Ogata S, Naka M, E. N, S. O, M. N. Comparison of effects of low-carbohydrate diet and calorie- restricted diet on nonalcoholic fatty liver disease in Japanese patients with type 2 diabetes. Diabetes [Internet]. 2018;67:A199‐. Available from: https://www.cochranelibrary.com/central/doi/10.1002/central/CN-01631152/full
- Siegmann MJ, Athinarayanan SJ, Hallberg SJ, McKenzie AL, Bhanpuri NH, Campbell WW, et al. Improvement in patient-reported sleep in type 2 diabetes and prediabetes participants receiving a continuous care intervention with nutritional ketosis. Sleep Med [Internet]. 2019 Mar 1 [cited 2019 Nov 4];55:92–9. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L2001573341
- Wang L-LL-L, Wang Q, Hong Y, Ojo O, Jiang Q, Hou Y-YY-Y, et al. The Effect of Low-Carbohydrate Diet on Glycemic Control in Patients with Type 2 Diabetes Mellitus. Nutrients [Internet]. 2018 May 23 [cited 2020 Jul 8];10(6):661. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L622288395
- Wycherley TP TCHBJDL-MNDNMWGA, Brinkworth GD, T.P. W, C.H. T, J.D. B, N.D. L-M, et al. Long-term effects of weight loss with a very-low carbohydrate, low saturated fat diet on flow mediated dilatation in patients with type 2 diabetes: A randomised controlled trial. Atherosclerosis [Internet]. 2016;252:28–31. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L611504212
- Athinarayanan SJ, Adams RN, Hallberg SJ, McKenzie AL, Bhanpuri NH, Campbell WW, et al. Long-term effects of a novel continuous remote care intervention including nutritional ketosis for the management of type 2 diabetes: A 2-year nonrandomized clinical trial. Front Endocrinol (Lausanne) [Internet]. 2019 Jun 5 [cited 2019 Dec 8];10(JUN). Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L628488803
- Lim EL, Hollingsworth KG, Aribisala BS, Chen MJ, Mathers JC, Taylor R. Reversal of type 2 diabetes: Normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia [Internet]. 2011 Oct [cited 2019 Dec 7];54(10):2506–14. Available from: http://search.ebscohost.com/login.aspx?direct=true&AuthType=ip,shib&db=cmedm&AN=21656330&site=ehost-live&custid=s4121186
- Jackness C, Karmally W, Febres G, Conwell IM, Ahmed L, Bessler M, et al. Very Low–Calorie Diet Mimics the Early Beneficial Effect of Roux-en-Y Gastric Bypass on Insulin Sensitivity and β-Cell Function in Type 2 Diabetic Patients. Diabetes [Internet]. 2013 Sep;62(9):3027–32. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L372062669
- Lingvay I, Guth E, Islam A, Livingston E. Rapid Improvement in Diabetes After Gastric Bypass Surgery. Diabetes Care [Internet]. 2013 Sep;36(9):2741–7. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L372062795
- Perry RJ, Peng L, Cline GW, Wang Y, Rabin-Court A, Song JD, et al. Mechanisms by which a Very-Low-Calorie Diet Reverses Hyperglycemia in a Rat Model of Type 2 Diabetes. Cell Metab [Internet]. 2017;27(1):210-217.e3. Available from: https://doi.org/10.1016/j.cmet.2017.10.004
- Al-Mrabeh A, Zhyzhneuskaya S V, Peters C, Barnes AC, Melhem S, Jesuthasan A, et al. Hepatic Lipoprotein Export and Remission of Human Type 2 Diabetes after Weight Loss. Cell Metab [Internet]. 2020 Feb [cited 2020 Feb 17];31(2):233-249.e4. Available from: https://doi.org/10.1016/j.cmet.2019.11.018
- Taylor R, Al-Mrabeh A, Zhyzhneuskaya S, Peters C, Barnes AC, Aribisala BS, et al. Remission of Human Type 2 Diabetes Requires Decrease in Liver and Pancreas Fat Content but Is Dependent upon Capacity for β Cell Recovery. Cell Metab [Internet]. 2018 Oct 2 [cited 2018 Oct 3];28(4):547-556.e3. Available from: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L2001264915
- Soto-Mota A, Vansant H, Evans RD, Clarke K. Safety and tolerability of sustained exogenous ketosis using ketone monoester drinks for 28 days in healthy adults. Regul Toxicol Pharmacol [Internet]. 2019 Dec [cited 2019 Oct 26];109:104506. Available from: https://linkinghub.elsevier.com/retrieve/pii/S0273230019302703
- Krauss RM. All Low-Density Lipoprotein Particles Are Not Created Equal. Arterioscler Thromb Vasc Biol [Internet]. 2014 May;34(5):959–61. Available from: https://www.ahajournals.org/doi/10.1161/ATVBAHA.114.303458
- Astrup A, Magkos F, Bier DM, Thomas Brenna J, de Oliveira Otto MC, Hill JO, et al. Saturated Fats and Health: A Reassessment and Proposal for Food-Based Recommendations: JACC State-of-the-Art Review. J Am Coll Cardiol [Internet]. 2020 Jun 17 [cited 2020 Jul 2];76(7):844–57. Available from: https://doi.org/10.1016/j.jacc.2020.05.077
- Hall KD, Chen KY, Guo J, Lam YY, Leibel RL, Mayer LES, et al. Energy expenditure and body composition changes after an isocaloric ketogenic diet in overweight and obese men. Am J Clin Nutr. 2016;104(2):324–33.






