Autor/es: Sebastian Reyes Lizaola
RESUMEN
INTRODUCCIÓN: La diabetes gestacional (DG) es un trastorno metabólico que inicia durante el embarazo, donde hay hiperglucemia por intolerancia a los carbohidratos. Actualmente hay pocas recomendaciones para guiar la dieta de mujeres mexicanas con DG, por lo que se realizó una revisión de la literatura para sugerir recomendaciones adicionales.
OBJETIVO: Determinar recomendaciones para la dieta de pacientes con DG en la población mexicana.
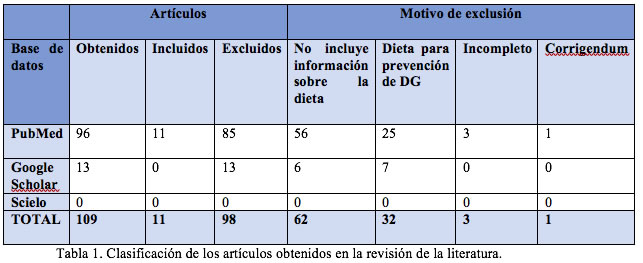
MÉTODO: Se hizo una revisión de la literatura en las bases de datos PubMed, Google Scholar y Scielo en mayo de 2022. Se obtuvieron un total de 109 artículos, de los cuales 11 (10.09%) fueron aceptados para la revisión y 98 excluidos (89.9%). Posteriormente, se procedió a su lectura crítica para realizar las secciones de resultados y conclusiones.
RESULTADOS: En la revisión de los artículos, se encontraron diversas recomendaciones para la dieta de pacientes con DG; con respecto a la ganancia de peso en el embarazo, la composición de la dieta, el tipo de carbohidratos, fibras, proteínas y grasas, los tipos de dietas actualmente aplicadas, y sobre el consumo de edulcorantes, cafeína, vitaminas y minerales.
CONCLUSIONES: No se ha llegado a un consenso global sobre las características ideales de la dieta para mujeres con DG. Con la información disponible al momento, se pudieron sugerir algunas recomendaciones, las cuales deben ser tomadas con cautela. Se requieren estudios de grupos grandes en México para comprobar la eficacia de estas recomendaciones.
PALABRAS CLAVE: diabetes gestacional, dieta, embarazo, nutrición, México.
ABSTRACT
BACKGROUND: Gestational diabetes (GD) is a metabolic disorder that begins during pregnancy, where there is hyperglycemia due to carbohydrate intolerance. There are currently few recommendations to guide the diet of Mexican women with GD; therefore, a literature review was conducted to suggest additional recommendations.
OBJETIVE: Determine recommendations for the diet of patients with GD in the Mexican population.
METHOD: A review of the literature was performed in the PubMed, Google Scholar, and Scielo databases in May 2022. A total of 109 articles were obtained, of which 11 (10.09%) were accepted for review and 98 excluded (89.9%). Subsequently, a critical reading of the articles was carried out to write the results and conclusions sections.
RESULTS: In the articles review, various recommendations were found for the diet of patients with GD, regarding weight gain in pregnancy, the composition of the diet, the type of carbohydrates, fibers, proteins, and fats, the types of diets currently applied, and on the consumption of sweeteners, caffeine, vitamins, and minerals.
CONCLUSIONS: No global consensus has been reached on the ideal characteristics of the diet for women with GD. Some recommendations can be suggested with the current information but should be taken cautiously. Large group studies in Mexico are required to verify the efficacy of these recommendations.
KEY WORDS: Gestational diabetes; Diet; Pregnancy; Nutrition; Mexico.
Introducción
La diabetes gestacional (DG) es un trastorno metabólico que inicia durante el embarazo, en el que se produce hiperglucemia debido a la intolerancia a los carbohidratos, y puede generar severas complicaciones en la madre y en el feto. Se estima que la prevalecía a nivel mundial es del 7% del total de los embarazos, mientras que en México está entre el 8.7 y 17.7% [1]. Esta patología es de gran importancia en el país, debido a su mayor prevalencia en la población mexicana [2-4].
Para su tratamiento, se ha demostrado la eficacia de la dieta como primer paso, aunque actualmente no se conoce la dieta ideal [5]. La Guía de Práctica Clínica para el diagnóstico y tratamiento de la diabetes en el embarazo del Instituto Mexicano del Seguro Social contiene las siguientes recomendaciones:
- Terapia médica nutricional proporcionada por un nutriólogo o dietista certificado, con experiencia en el manejo de diabetes y embarazo.
- Dieta culturalmente apropiada e individualizada a las necesidades de la mujer.
- Dieta con especial atención a los carbohidratos y su índice glucémico; se menciona que, en un ensayo, la dieta de bajo índice glucémico tuvo un efecto positivo en el control de peso materno y en los niveles de glucosa.
- Dieta con 3 comidas y de 2 a 3 colaciones al día [1].
Hoy en día, no hay más recomendaciones que puedan guiar la dieta como tratamiento de mujeres mexicanas con DG. Debido a la falta de información sobre el tema, se realizó una revisión de la literatura internacional para sugerir recomendaciones adicionales para su dieta.
Método
Se inició con la revisión de la literatura en las bases de datos PubMed, Google Scholar y Scielo en mayo de 2022. Se obtuvieron un total de 109 artículos, de los cuales 11 (10.09%) fueron aceptados para la revisión y 98 excluidos (89.9%). Un total de 62 artículos fueron excluidos debido a que no trataban acerca de la dieta y sus características ideales para pacientes con DG, posteriormente 32 se excluyeron por tratarse de la dieta adecuada para prevención de DG. Finalmente 3 artículos se excluyeron por estar incompletos y 1 por tratarse de un corrigendum.
En la base de datos PubMed se obtuvieron un total de 96 artículos mediante los siguientes descriptores: gestational diabetes[Title] AND ((diet[Title]) OR (nutrition[Title])). Asimismo, se incluyeron como filtro artículos de los últimos 10 años (2012 – 2022), de libre acceso. Para la base de datos de Google Scholar se obtuvieron un total de 13 artículos mediante los siguientes descriptores: allintitle: Diabetes gestacional dieta. Además, se incluyeron como filtro artículos de los últimos 10 años (2012 – 2022), en idioma español. Por último, en la base de datos Scielo no se obtuvieron artículos al realizar la búsqueda con los siguientes descriptores: (ti:((Diabetes gestacional) AND (Dieta))).
A continuación, se hizo una lectura crítica de los artículos aceptados para realizar las secciones de resultados y conclusiones, así como para sugerir las recomendaciones para la dieta de mujeres con DG en México.
Resultados
Durante la revisión de los artículos aceptados, se encontraron diversas recomendaciones para la dieta de pacientes con DG.
Con respecto al peso, se recomienda la misma ganancia ponderal que la de las pacientes embarazadas sin DG, tomando en cuenta el Índice de Masa Corporal (IMC) como se muestra en la siguiente tabla [6]:

Se debe evitar el aumento excesivo de peso fuera de los parámetros antes mencionados para prevenir complicaciones [7]. En mujeres con obesidad, se puede aplicar una restricción del 30 al 33% de las calorías necesarias de la dieta, para mantener la ganancia ponderal adecuada durante el embarazo, y reducir los niveles de glucosa y triglicéridos [8].
Con respecto a la composición de la dieta, la Academia Nacional de Medicina de Estados Unidos, también conocida como Institute of Medicine (IOM), recomienda que la dieta para pacientes con DG este compuesta en un 46 – 65% de carbohidratos, con un mínimo de 175 g diarios para asegurar un crecimiento fetal y desarrollo placentario adecuados [9,10,11]. En comparación, otras guías recomiendan que el porcentaje de carbohidratos en la dieta se encuentre entre el 40 – 50% [12].
En un estudio cruzado aleatorizado no se encontraron diferencias en los niveles de glucosa en ayuno al comparar dietas compuestas de 40% carbohidratos a dietas con el 60% de carbohidratos [13]. Sin embargo, en un estudio aleatorizado se encontró que las mujeres en el grupo con una dieta compuesta por carbohidratos de alta calidad en un 60% tuvieron una glucosa en ayuno menor en comparación con el grupo con una dieta de 40% carbohidratos [14].
Los carbohidratos de la dieta se recomiendan que sean principalmente de alta calidad (complejos y ricos en nutrientes), con un bajo índice glucémico (IG) < 55, y con un alto contenido de fibra; algunos ejemplos se pueden encontrar en las frutas, verduras, cereales integrales y legumbres [15,16]. Las dietas con carbohidratos de lenta absorción con un bajo IG se han asociado a mejores niveles en la glucosa plasmática en ayuno y en el perfil de lípidos, a un menor requerimiento de insulina durante el embarazo, y a un peso menor en el producto al momento del nacimiento [17-20].
Se recomienda realizar tres comidas principales con 2 a 3 colaciones durante el día que incluyan carbohidratos de alta calidad para evitar picos posprandiales de glucosa por un consumo excesivo de alimentos o de carbohidratos simples en una sola comida [21,22]. Durante el desayuno, se sugiere el consumo de máximo 15-30 g de carbohidratos debido al pico matutino en la secreción de cortisol que eleva los niveles de glucosa [23].
De igual forma, se debe evitar el consumo excesivo de azúcares añadidos [24], así como las dietas bajas en carbohidratos, ya que usualmente son reemplazados por grasas las cuales en exceso están asociadas a un aumento de los ácidos grasos y resistencia a la insulina en la madre, y a un aumento en la grasa fetal [13].
En un ensayo controlado aleatorizado no se encontraron diferencias en el requerimiento de insulina en el grupo con una dieta baja en carbohidratos en la que aportaban el 40% de las calorías, en comparación con el grupo con una dieta en donde aportaban el 55% [25]. Asimismo, este tipo de dietas bajas en carbohidratos favorecen la producción de cuerpos cetónicos, los cuales se han asociado a un desarrollo cognitivo y motor menor en el feto [10,26]. En cambio, las dietas con carbohidratos de bajo IG, donde aportan al menos el 50% de las calorías, se han asociado a un mejor apego al tratamiento [27].
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) establece que el uso moderado de los siguientes edulcorantes no nutritivos es seguro durante el embarazo: acesulfamo de potasio, aspartamo, glucósidos de esteviol y sacarina [28]. Sin embargo, existen reportes que los han asociado a un riesgo futuro de obesidad y a una mala salud cardio metabólica [29]. Además, el consumo de sacarina se ha prohibido durante el embarazo en algunos países, ya que existen reportes de que podría cruzar la placenta y permanecer en los tejidos fetales, pudiendo producir efectos adversos desconocidos hasta el momento [23].
La Asociación Americana de la Diabetes (ADA) recomienda para mujeres con DG el consumo de al menos 28 g de fibra y 175 g de carbohidratos al día [11]. Se recomienda el consumo de frutas y verduras con alto contenido de fibra, así como la selección de arroz, pan y pasta integrales, los cuales contienen una mayor cantidad de fibra y un IG más bajo que los productos refinados [24]. En su mayoría, los productos con un bajo IG tienen un mayor contenido de fibra. Asimismo, la fibra soluble ha demostrado tener un beneficio mayor para reducir los niveles de lípidos y los picos glucémicos [30].
Con respecto a las proteínas, la IOM estima su requerimiento diario en 0.88 g /kg al día y recomienda que aporten del 10 al 35% de las calorías de la dieta, y al igual que la ADA, recomienda un consumo diario mínimo de 71 g [6,11]. Un exceso en su consumo o una ingesta en cantidades menores a las recomendadas han sido asociados a un bajo peso al nacer [31]. Se recomienda incluir el consumo de proteína animal, ya que aporta los nueve aminoácidos esenciales, a diferencia de las dietas compuestas únicamente de proteína vegetal, que pueden no contener uno o más de los aminoácidos esenciales [32].
De igual forma, se ha demostrado que, en comparación con la obtención de proteínas de carne roja y procesada, el consumo de proteína proveniente del pescado, carne magra (pollo, pavo) y plantas, puede mejorar la sensibilidad a la insulina, debido a que estos alimentos tienen un menor porcentaje de carbohidratos y grasas saturadas [33,34]. Sin embargo, la calidad de los alimentos también debe de tomarse en cuenta; por ejemplo, el pescado, que es una excelente fuente de proteína, hierro y omega-3, en su mayoría se obtiene de aguas contaminadas con mercurio, y su consumo excesivo podría producir una intoxicación [35].
Con respecto a las grasas, la IOM recomienda que aporten del 20 al 35% de las calorías de la dieta, manteniendo baja la ingesta de grasas saturadas. Así como un consumo diario mínimo de 13 g de ácido linolénico (omega-6) y 1.4 g de ácido linoleico (omega-3), los cuales se encuentran en cantidades suficientes en el pescado [6,36].
Durante el embarazo los requerimientos de vitaminas y minerales aumentan [37], la IOM recomienda en este periodo la ingesta diaria de 600 microgramos de ácido fólico, 5 microgramos de 25-Hydroxivitamina D, 1000 miligramos de calcio y 27 miligramos de hierro [6]. Hasta el momento, no existe evidencia suficiente que justifique una ingesta diferente de vitaminas y minerales para las mujeres con DG [24].
Aunque no existen recomendaciones específicas para la suplementación en mujeres con DG, en su mayoría las vitaminas y minerales se encuentran alterados debido a la presencia de obesidad. Actualmente se sabe que la obesidad materna confiere el doble de riesgo para defectos del tubo neural por una distribución alterada del folato [38,39]. Asimismo, la obesidad materna esta correlacionada negativamente con los niveles plasmáticos de vitamina B12, y los niveles bajos de esta vitamina a su vez están asociados a un riesgo de 2.5 a 3 veces más de presentar defectos del tubo neural [40].
Igualmente, se ha encontrado que las mujeres embarazadas con obesidad presentan niveles inadecuados de vitamina 25(OH)D [41]. Algunos reportes demuestran que la suplementación de vitamina D, en pacientes con DG, disminuye los niveles de glucosa en ayuno, los niveles de insulina y la resistencia a la insulina [42,43]. Este efecto, puede deberse a que la vitamina D disminuye la inflamación sistémica, la cual se ha asociado a un aumento de la resistencia a la insulina [44,45].
Respecto al consumo de cafeína, las pacientes con DG deben seguir las mismas recomendaciones que existen para mujeres embarazadas sin DG, y limitar su consumo a un máximo de 200 mg al día [23]. Dentro del grupo de bebidas que contienen cafeína se encuentran el café, las bebidas energéticas, y algunos tés y refrescos.
Respecto al uso de probióticos, existen múltiples reportes que han estudiado su efecto en la prevención o tratamiento de DG, sin embargo, aún no se obtienen resultados concluyentes [24].
Actualmente, se acepta como tratamiento de primera línea para DG la terapia nutricional, ya que, en la mayoría de las ocasiones, regula los parámetros de glucosa alterados en la madre y evita la ganancia excesiva de peso por parte del feto en útero, sin la necesidad de utilizar medicamentos [46].
Existen múltiples dietas que se han aplicado con ese fin cuyo beneficio ha sido comprobado, por ejemplo, se ha demostrado que se pueden adecuar dietas específicas para mujeres veganas con DG, siempre y cuando se suplementen con hierro y vitamina B12, y se asegure que en los alimentos las proteínas incluidas contengan todos los aminoácidos esenciales [47].
Otra dieta que se ha estudiado para mujeres con DG es la dieta DASH (Dietary Approaches to Stop Hypertension). En un estudio controlado aleatorizado se obtuvieron mejores resultados en el grupo con dieta DASH, que en el grupo con una dieta compuesta de 45-55% carbohidratos, 15-20% proteínas, y 25-30% grasas. En el grupo con la dieta DASH, se realizaron menos cesáreas, y un menor porcentaje de las participantes requirió del uso de insulina, asimismo, sus bebes tuvieron un menor peso al nacer en comparación con el otro grupo [48].
Finalmente, la dieta que actualmente más se recomienda para mujeres con DG es la dieta mediterránea, la cual se considera segura durante el embarazo y tiene un bajo contenido de grasas saturadas, bebidas azucaradas y carne procesada, así como un alto contenido de frutas, vegetales, aceite de oliva, frutos secos, legumbres, cereales no refinados y pescado [49,50]. Debido a sus características, también se ha utilizado en la prevención de obesidad y DG, donde se ha demostrado su eficacia para reducir el riesgo de desarrollar DG [51,52].
Independientemente de la dieta que se seleccione, es importante que esta no sea restrictiva, ya que las dietas con un enfoque no restrictivo están asociadas a un mayor bienestar psicológico, y mayor compromiso y autoconfianza por parte de las mujeres, lo que genera un mayor apego al programa nutricional seleccionado [53]. El apego a la terapia nutricional es un factor importante para tomar en cuenta en los estudios, debido a que es uno de los principales factores de confusión al analizar los resultados [54].
Aunque existen discrepancias sobre las características adecuadas para la dieta de mujeres con DG, la mayoría de las guías y estudios concuerdan en que, para lograr un buen control glicémico y un correcto funcionamiento de la insulina, el programa nutricional debe incluir una mezcla de carbohidratos complejos de alta calidad con un IG bajo, una alta cantidad de fibra, proteínas con los aminoácidos esenciales, y una baja cantidad de grasas [14].
En México, para las mujeres con DG, las características nutricionales previamente mencionadas, se pueden cumplir con la dieta mediterránea o un programa nutricional similar. La mayoría de los alimentos incluidos en la dieta mediterránea se encuentran en abundancia y son accesibles para la población, como, por ejemplo, frutas, verduras, frijoles, nueces, aceite de oliva, queso y productos lácteos bajos en grasa, pollo, pescado y granos integrales como maíz, arroz integral, quinoa y amaranto [14].
Conclusiones
Debido a las singularidades de cada población, no se ha podido llegar a un consenso global sobre las características ideales de la dieta para mujeres con DG, por lo que existen múltiples guías con sus respectivas recomendaciones. Además, los estudios que existen al momento, y sobre los cuales se basan las guías, tienen limitantes importantes, en su mayoría, la incertidumbre del cumplimiento estricto de la terapia nutricional, así como la poca cantidad de mujeres que participa en cada estudio. Sin embargo, de acuerdo con la información disponible al momento, se pueden hacer las siguientes recomendaciones:
- Terapia médica nutricional proporcionada por un nutriólogo o dietista certificado, con experiencia en el manejo de diabetes y embarazo.
- Ganancia de peso igual al de las mujeres embarazadas sin DG, tomando en cuenta el IMC.
- Dieta con 46 – 65% de carbohidratos, con un mínimo de 175 g al día.
- Carbohidratos de alta calidad con un bajo índice glucémico.
- Realizar 3 comidas principales con 2 a 3 colaciones al día.
- En el desayuno consumir un máximo de 15-30 g de carbohidratos.
- Evitar dietas restrictivas, con bajo porcentaje de carbohidratos.
- Evitar el consumo excesivo de azúcares añadidos.
- Evitar o disminuir el consumo de edulcorantes no nutritivos.
- Dieta con al menos 28 g de fibra al día, preferir los alimentos con fibra soluble.
- Dieta con 10 – 35% de proteínas, con un mínimo de 71 g al día.
- Dieta con proteínas que contengan los 9 aminoácidos esenciales.
- Dieta con 20 – 35% de grasas, con un mínimo de 13 g de ácido linolénico (omega-6) y 1.4 g de ácido linoleico (omega-3) al día.
- Suplementación con 600 microgramos de ácido fólico, 5 microgramos de 25-Hydroxivitamina D, 1000 miligramos de calcio y 27 miligramos de hierro.
- Considerar la suplementación de vitamina B12.
- Considerar la aplicación de la dieta mediterránea.
- Individualizar la dieta a las características específicas de cada mujer.
Por último, es importante mencionar que estas recomendaciones deben tomarse con cautela, ya que muchos de los estudios realizados hasta el momento se hicieron en grupos de estudio con pocas integrantes y de diferentes orígenes étnicos. Se deben realizar estudios en grupos grandes en México para comprobar la eficacia de estas recomendaciones en mujeres mexicanas y sugerir su implementación en las guías oficiales del país para beneficio de toda la población.
Referencias
-
-
- Diagnóstico y tratamiento de la diabetes en el embarazo. México: Instituto Mexicano del Seguro Social; 03/11/2016.
- Hedderson MM, Darbinian JA, Ferrara A. Disparities in the risk of gestational diabetes by race-ethnicity and country of birth. Peadiatr Perinat Epidemiol. 2014; 24:441-8. doi: 10.1111/j.1365-3016.2010.01140.x
- McDonald R, Karahalios A, Thao L, Joanne S. A retrospective analysis of the relationship between ethnicity and gestational diabetes. Int J Endocrinol. 2015;2015:1-7. doi:10.1155/2015/297420
- Font-López KC, Gutiérrez-Castañeda MR. Diagnóstico de diabetes gestacional en población mexicana. Ginecol Obstet Mex. 2017;85(02):116-124.
- Vigil-De Gracia P, Olmedo J. Diabetes gestacional: conceptos actuales. Ginecol. obstet. Méx. [revista en la Internet]. 2017 [citado 2022 Mayo 16] ; 85( 6 ): 380-390. Disponible en: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0300-90412017000600380&lng=es.
- Yaktine A.L., Rasmussen K.M., Youth F., National Research Council. Institute of Medicine. Board on Children. Committee to Reexamine IOM Pregnancy Weight Guidelines. In: Weight Gain During Pregnancy: Reexamining the Guidelines (2009) Rasmussen K.M., Yaktine A.L., editors. The National Academies Press; Washington, DC, USA: 2009.
- Viecceli C., Remonti L., Hirakata V., Mastella L., Gnielka V., Oppermann M., Silveiro S., Reichelt A. Weight gain adequacy and pregnancy outcomes in gestational diabetes: A meta-analysis. Rev. 2017;18:567–580. doi: 10.1111/obr.12521
- Franz M.J. Lifestyle modifications for diabetes management. Endocrinol. Metab. Clin. N. Am. 1997;26:499–510. doi: 10.1016/S0889-8529(05)70263-2.
- Hay W.W. Placental-Fetal Glucose Exchange and Fetal Glucose Metabolism. Trans. Am. Clin. Clim. Assoc. 2006;117:321–340.
- McIntyre H.D., Catalano P., Zhang C., Desoye G., Mathiesen E.R., Damm P. Gestational diabetes mellitus. Nat. Rev. Dis. Prim. 2019;5:47. doi: 10.1038/s41572-019-0098-8.
- American Diabetes Association 14 Management of Diabetes in Pregnancy: Standards of Medical Care in Diabetes—2020. Diabetes Care. 2019;43:S183–S192. doi: 10.2337/dc20-S014.
- Tamás G., Kerényi Z. Gestational diabetes: Current aspects on pathogenesis and treatment. Exp. Clin. Endocrinol. Diabetes. 2001;109:400–411. doi: 10.1055/s-2001-18598.
- Hernandez T.L., Van Pelt R.E., Anderson M.A., Daniels L.J., West N.A., Donahoo W.T., Friedman J.E., Barbour L.A. A Higher-Complex Carbohydrate Diet in Gestational Diabetes Mellitus Achieves Glucose Targets and Lowers Postprandial Lipids: A Randomized Crossover Study. Diabetes Care. 2014;37:1254–1262. doi: 10.2337/dc13-2411.
- Hernandez TL, Mande A, Barbour LA. Nutrition therapy within and beyond gestational diabetes. Diabetes Res Clin Pract. 2018 Nov;145:39-50. doi: 10.1016/j.diabres.2018.04.004. Epub 2018 Apr 19. PMID: 29679625; PMCID: PMC6195478.
- American Diabetes Association. Bantle J.P., Wylie-Rosett J., Albright A.L., Apovian C.M., Clark N.G., Franz M.J., Hoogwerf B.J., Lichtenstein A.H., Mayer-Davis E., et al. Nutrition Recommendations and Interventions for Diabetes: A position statement of the American Diabetes Association. Diabetes Care. 2007;31(Suppl. 1):S61–S78. doi: 10.2337/dc08-s061.
- Nutrition Subcommittee of the Diabetes Care Advisory Committee of Diabetes UK The implementation of nutritional advice for people with diabetes. Diabet. Med. 2003;20(Suppl. 2):786–807. doi: 10.1046/j.1464-5491.2003.01104.x.
- Moses R.G., Barker M., Winter M., Petocz P., Brand-Miller J.C. Can a Low–Glycemic Index Diet Reduce the Need for Insulin in Gestational Diabetes Mellitus? Diabetes Care. 2009;32:996–1000. doi: 10.2337/dc09-0007.
- Verçoza Viana L, Gross JL, Azevedo MJ. Dietary intervention in patients with gestational diabetes mellitus: A systematic review and meta-analysis of randomized clinical trials on maternal and newborn outcomes. Diabetes Care (2014) 37:3345–55. 2337/dc14-1530
- Filardi T, Panimolle F, Crescioli C, Lenzi A, Morano S. Gestational Diabetes Mellitus: The Impact of Carbohydrate Quality in Diet. Nutrients. 2019 Jul 9;11(7):1549. doi: 10.3390/nu11071549. PMID: 31323991; PMCID: PMC6683084.
- Afaghi A, Ghanei L, Ziaee A. Effect of low glycemic load diet with and without wheat bran on glucose control in gestational diabetes mellitus: A randomized trial. Indian J Endocrinol Metab. 2013 Jul;17(4):689-92. doi: 10.4103/2230-8210.113762. PMID: 23961487; PMCID: PMC3743371.
- Ovesen P., Fuglsang J., Andersen M.B., Wolff C., Petersen O.B., McIntyre H.D. Temporal Trends in Gestational Diabetes Prevalence, Treatment, and Outcomes at Aarhus University Hospital, Skejby, between 2004 and 2016. J. Diabetes Res. 2018;2018:1–6.
- Small P, Brand-Miller JC. From complex carbohydrate to glycemic index: Tracing the controversy. Nutrition Today. 2009;44:236–43.
- Vasile FC, Preda A, Ștefan AG, Vladu MI, Forțofoiu MC, Clenciu D, Gheorghe IO, Forțofoiu M, Moța M. An Update of Medical Nutrition Therapy in Gestational Diabetes Mellitus. J Diabetes Res. 2021 Nov 18;2021:5266919. doi: 10.1155/2021/5266919. PMID: 34840988; PMCID: PMC8616668.
- Rasmussen L, Poulsen CW, Kampmann U, Smedegaard SB, Ovesen PG, Fuglsang J. Diet and Healthy Lifestyle in the Management of Gestational Diabetes Mellitus. Nutrients. 2020 Oct 6;12(10):3050. doi: 10.3390/nu12103050. PMID: 33036170; PMCID: PMC7599681.
- Moreno-Castilla C, Hernandez M, Bergua M, Alvarez MC, Arce MA, Rodriguez K, Martinez-Alonso M, Iglesias M, Mateu M, Santos MD, Pacheco LR, Blasco Y, Martin E, Balsells N, Aranda N, Mauricio D. Low-carbohydrate diet for the treatment of gestational diabetes mellitus: a randomized controlled trial. Diabetes Care. 2013 Aug;36(8):2233-8. doi: 10.2337/dc12-2714. Epub 2013 Apr 5. PMID: 23564917; PMCID: PMC3714525.
- Magee MS, Knopp RH, Benedetti TJ. Metabolic effects of 1200-kcal diet in obese pregnant women with gestational diabetes. Diabetes. 1990;39:234–40.
- Mahajan A, Donovan LE, Vallee R, Yamamoto JM. Evidenced-Based Nutrition for Gestational Diabetes Mellitus. Curr Diabetes Rep (2019) 19(10):94. 1007/s11892-019-1208-4
- Additional Information about High-Intensity Sweeteners Permitted for Use in Food in the United States. [(consultado 28 Mayo 2022)]; Disponible en: https://www.fda.gov/food/food-additives-petitions/additional-information-about-high-intensity-sweeteners-permitted-use-food-united-states.
- Azad MB, Abou-Setta AM, Chauhan BF, Rabbani R, Lys J, Copstein L, et al. Nonnutritive sweeteners and cardiometabolic health: a systematic review and meta-analysis of randomized controlled trials and prospective cohort studies. CMAJ. 2017;189:E929–E39.
- Kapur K, Kapur A, Hod M. Nutrition Management of Gestational Diabetes Mellitus. Ann Nutr Metab. 2021 Feb 1:1-13. doi: 10.1159/000509900. Epub ahead of print. PMID: 33524988.
- Hanson MA, Gluckman PD. Early developmental conditioning of later health and disease: physiology or pathophysiology? Physiol Rev. 2014;94:1027–76.
- Melina V., Craig W., Levin S. Position of the Academy of Nutrition and Dietetics: Vegetarian Diets. J. Acad. Nutr. Diet. 2016;116:1970–1980. doi: 10.1016/j.jand.2016.09.025.
- Saldana T.M., Siega-Riz A.M., Adair L.S. Effect of macronutrient intake on the development of glucose intolerance during pregnancy. Am. J. Clin. Nutr. 2004;79:479–486. doi: 10.1093/ajcn/79.3.479.
- Bo S., Menato G., Lezo A., Signorile A., Bardelli C., De Michieli F., Massobrio M., Pagano G. Dietary fat and gestational hyperglycaemia. Diabetologia. 2001;44:972–978. doi: 10.1007/s001250100590.
- Swain E. B., Jakus P. M., Rice G., et al. Socioeconomic consequences of mercury use and pollution. Ambio. 2007;36(1):45–61. doi: 10.1579/0044-7447(2007)36[45:SCOMUA]2.0.CO;2.
- Koletzko B., Lien E., Agostoni C., Böhles H., Campoy C., Cetin I., Decsi T., Dudenhausen J.W., Dupont C., Forsyth S., et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: Review of current knowledge and consensus recommendations. J. Périnat. Med. 2008;36:5–14. doi: 10.1515/JPM.2008.001.
- Kominiarek M.A., Rajan P. Nutrition Recommendations in Pregnancy and Lactation. Med. Clin. 2016;100:1199–1215. doi: 10.1016/j.mcna.2016.06.004.
- Rasmussen SA, Chu SY, Kim SY, Schmid CH, Lau J. Maternal obesity and risk of neural tube defects: a metaanalysis. Am J Obstet Gynecol (2008) 198:611–9. 1016/j.ajog.2008.04.021
- Stern SJ, Matok I, Kapur B, Koren G. A comparison of folic acid pharmacokinetics in obese and nonobese women of childbearing age. Ther Drug Monit (2011) 33:336–40. 1097/FTD.0b013e318219407a
- Molloy AM, Kirke PN, Troendle JF, Burke H, Sutton M, Brody LC, et al. Maternal vitamin B12 status and risk of neural tube defects in a population with high neural tube defect prevalence and no folic acid fortification. Pediatrics (2009) 123:917–23. 1542/peds.2008-1173
- McAree T. Obesity and vitamin D deficiency-current concepts on their impact on pregnancy. Eur Endocrinol (2013) 9:125–7. 17925/ee.2013.09.02.125
- Asemi Z., Hashemi T., Karamali M., Samimi M., Esmaillzadeh A. Effects of vitamin D supplementation on glucose metabolism, lipid concentrations, inflammation, and oxidative stress in gestational diabetes: A double-blind randomized controlled clinical trial. Am. J. Clin. Nutr. 2013;98:1425–1432. doi: 10.3945/ajcn.113.072785.
- Asemi Z., Karamali M., Esmaillzadeh A. Effects of calcium–vitamin D co-supplementation on glycaemic control, inflammation and oxidative stress in gestational diabetes: A randomised placebo-controlled trial. Diabetologia. 2014;57:1798–1806. doi: 10.1007/s00125-014-3293-x.
- Mitri J., Pittas A.G. Vitamin D and Diabetes. Endocrinol. Metab. Clin. North Am. 2014;43:205–232. doi: 10.1016/j.ecl.2013.09.010.
- Alvarez J.A., Ashraf A.P. Role of Vitamin D in Insulin Secretion and Insulin Sensitivity for Glucose Homeostasis. Int. J. Endocrinol. 2009;2010:1–18. doi: 10.1155/2010/351385.
- Yamamoto JM, Kellett JE, Balsells M, García-Patterson A, Hadar E, Solà I, Gich I, van der Beek EM, Castañeda-Gutiérrez E, Heinonen S, Hod M, Laitinen K, Olsen SF, Poston L, Rueda R, Rust P, van Lieshout L, Schelkle B, Murphy HR, Corcoy R. Gestational Diabetes Mellitus and Diet: A Systematic Review and Meta-analysis of Randomized Controlled Trials Examining the Impact of Modified Dietary Interventions on Maternal Glucose Control and Neonatal Birth Weight. Diabetes Care. 2018 Jul;41(7):1346-1361. doi: 10.2337/dc18-0102. PMID: 29934478.
- Piccoli G.B., Clari R., Vigotti F., Leone F., Attini R., Cabiddu G., Mauro G., Castelluccia N., Colombi N., Capizzi I., et al. Vegan-vegetarian diets in pregnancy: Danger or panacea? A systematic narrative review. BJOG Int. J. Obstet. Gynaecol. 2015;122:623–633. doi: 10.1111/1471-0528.13280.
- Asemi Z, Samimi M, Tabassi Z, Esmaillzadeh A. The effect of DASH diet on pregnancy outcomes in gestational diabetes: a randomized controlled clinical trial. Eur J Clin Nutr. 2014;68(4):490–5.
- Estruch R., Ros E., Salas-Salvadó J., Covas M.I., Corella D., Arós F., Gómez-Gracia E., Ruiz-Gutiérrez V., Fiol M., Lapetra J., et al. Primary prevention of cardiovascular disease with a Mediterranean diet. N. Engl. J. Med. 2013;368:1279–1290. doi: 10.1056/NEJMoa1200303.
- Parrettini S, Caroli A, Torlone E. Nutrition and Metabolic Adaptations in Physiological and Complicated Pregnancy: Focus on Obesity and Gestational Diabetes. Front Endocrinol (Lausanne). 2020 Nov 30;11:611929. doi: 10.3389/fendo.2020.611929. PMID: 33424775; PMCID: PMC7793966.
- Al Wattar B.H., Dodds J., Placzek A., Beresford L., Spyreli E., Moore A., Gonzalez Carreras F.J., Austin F., Murugesu N., Roseboom T.J., et al. Mediterranean-style diet in pregnant women with metabolic risk factors (ESTEEM): A pragmatic multicentre randomised trial. PLoS Med. 2019;16:e1002857. doi: 10.1371/journal.pmed.1002857.
- Pérez-Pérez A, Vilariño-García T, Guadix P, Dueñas JL, Sánchez-Margalet V. Leptin and Nutrition in Gestational Diabetes. Nutrients. 2020 Jul 2;12(7):1970. doi: 10.3390/nu12071970. PMID: 32630697; PMCID: PMC7400219.
- Teixeira PJ, Carraca EV, Marques MM, Rutter H, Oppert JM, De BI, et al. Successful behavior change in obesity interventions in adults: a systematic review of self -regulation mediators. BMC Med. 2015;13:84.
- Hernandez TL, Anderson MA, Chartier-Logan C, Friedman JE, Barbour LA. Strategies in the nutritional management of gestational diabetes. Clin Obstet Gynecol. 2013;56:803–15.
-